jueves, 23 de mayo de 2013
HIDRÁULICA
HIDRAULICA
La Hidraulica es la tecnología que emplea un líquido, bien agua o aceite (normalmente aceites especiales), como modo de transmisión de la energía necesaria para mover y hacer funcionar mecanismos. Básicamente consiste en hacer aumentar la presíon de este fluido (el aceite) por medio de elementos del circuito hidraulico (compresor) para utilizarla como un trabajo útil,
normalmente en un elemento de salida llamado cilindro. El aumento de esta presión se puede ver y estudiar mediante el principio de Pascal.
Los cilindros solo tienen recorrido de avance y retroceso en movimiento rectilíneo, es por eso que si queremos otro movimiento deberemos acoplar al cilindro un mecanismo que haga el cambio de movimiento.
En un sistema hidráulico el aceite sustituye al aire comprimido que se usa en neumática. Muchas excavadoras, el camión de la basura, los coches, etc utilizan sistemas hidraúlicos para mover mecanismos que están unidos a un cilindro hidraulico movido por aceite.
Al llamarse hidraúlica puede pensarse que solo usa agua, cosa que no es así, es más casi nunca se usa agua solo se usa aceite. En la teoría si se usa aceite debería llamarse Oleohidraúlica, pero no es así. En la práctica cuando hablamos de sistemas por aceite, agua o cualquier fluido líquido usamos la palabra hidraúlica.
VIDEO: http://www.youtube.com/watch?v=Wn8RraSQguo&feature=youtu.be
La Hidraulica es la tecnología que emplea un líquido, bien agua o aceite (normalmente aceites especiales), como modo de transmisión de la energía necesaria para mover y hacer funcionar mecanismos. Básicamente consiste en hacer aumentar la presíon de este fluido (el aceite) por medio de elementos del circuito hidraulico (compresor) para utilizarla como un trabajo útil,
normalmente en un elemento de salida llamado cilindro. El aumento de esta presión se puede ver y estudiar mediante el principio de Pascal.
Los cilindros solo tienen recorrido de avance y retroceso en movimiento rectilíneo, es por eso que si queremos otro movimiento deberemos acoplar al cilindro un mecanismo que haga el cambio de movimiento.
En un sistema hidráulico el aceite sustituye al aire comprimido que se usa en neumática. Muchas excavadoras, el camión de la basura, los coches, etc utilizan sistemas hidraúlicos para mover mecanismos que están unidos a un cilindro hidraulico movido por aceite.
Al llamarse hidraúlica puede pensarse que solo usa agua, cosa que no es así, es más casi nunca se usa agua solo se usa aceite. En la teoría si se usa aceite debería llamarse Oleohidraúlica, pero no es así. En la práctica cuando hablamos de sistemas por aceite, agua o cualquier fluido líquido usamos la palabra hidraúlica.
VIDEO: http://www.youtube.com/watch?v=Wn8RraSQguo&feature=youtu.be
CARACTERÍSTICAS DE LOS LÍQUIDOS
CARACTERISICAS DE LOS LIQUIDOS
1. no tiene forma propia
2. volumen definido
3. fluyen
4 menor fuerza de cohesion
5. mayor energia cinetica
6. poseen tension superficial
7.capilaridad(pueden subir por tubos pequeños, como los capilares sanguineos)
8 Viscosidad
9 Ductilidad característica de los líquidos y/o gases que les confiere la habilidad de poder pasar por cualquier orificio o agujero por mas pequeño que sea siempre que esté a un mismo o inferior nivel del recipiente en el que se encuentren (el líquido y el gas), a diferencia del restante estado de agregación conocido como sólido.
VIDEO: http://www.youtube.com/watch?v=xtkl-j6DyTU
1. no tiene forma propia
2. volumen definido
3. fluyen
4 menor fuerza de cohesion
5. mayor energia cinetica
6. poseen tension superficial
7.capilaridad(pueden subir por tubos pequeños, como los capilares sanguineos)
8 Viscosidad
9 Ductilidad característica de los líquidos y/o gases que les confiere la habilidad de poder pasar por cualquier orificio o agujero por mas pequeño que sea siempre que esté a un mismo o inferior nivel del recipiente en el que se encuentren (el líquido y el gas), a diferencia del restante estado de agregación conocido como sólido.
VIDEO: http://www.youtube.com/watch?v=xtkl-j6DyTU
DENSIDAD Y SU PESO ESPECIFICO
Densidad y Peso Específico
La densidad está relacionada con el grado de acumulación de materia (un cuerpo compacto es, por lo general, más denso que otro más disperso), pero también lo está con el peso. Así, un cuerpo pequeño que es mucho más pesado que otro más grande es también mucho más denso.
d = densidad
d = m/v = masa/ volumen = kg/m3
Esto es debido a la relación de Peso, asi,
P = m · g existente entre masa y peso.
No obstante, para referirse al peso por unidad de volumen la física ha introducido el concepto de peso específico Pe que se define como el cociente entre el peso P de un cuerpo y su volumen.
El peso específico representa la fuerza con que la Tierra atrae a un volumen unidad de la misma sustancia considerada.
Pe = P/v = peso/volumen = Newton/m3
La unidad del peso específico en el SI es el N/m3
La relación entre peso específico y densidad es la misma que la existente entre peso y masa. En efecto:
siendo g la aceleración de la gravedad.
Peso = P = m*g = masa*gravedad
Sustituimos P en la formula de Pe y tenemos que:
Pe = (m*g)/v = d*g = densidad por aceleración de la gravedad
Densidades de algunos elementos
Agua = 1000 kg/m3
Glicerina = 1260
Alcohol etílico = 810
Madera de pino = 420
Platino = 21400
Huesos = 1700 y 2000
VIDEO: https://www.youtube.com/watch?feature=player_embedded&v=4DXRk3j036I
La densidad está relacionada con el grado de acumulación de materia (un cuerpo compacto es, por lo general, más denso que otro más disperso), pero también lo está con el peso. Así, un cuerpo pequeño que es mucho más pesado que otro más grande es también mucho más denso.
d = densidad
d = m/v = masa/ volumen = kg/m3
Esto es debido a la relación de Peso, asi,
P = m · g existente entre masa y peso.
No obstante, para referirse al peso por unidad de volumen la física ha introducido el concepto de peso específico Pe que se define como el cociente entre el peso P de un cuerpo y su volumen.
El peso específico representa la fuerza con que la Tierra atrae a un volumen unidad de la misma sustancia considerada.
Pe = P/v = peso/volumen = Newton/m3
La unidad del peso específico en el SI es el N/m3
La relación entre peso específico y densidad es la misma que la existente entre peso y masa. En efecto:
siendo g la aceleración de la gravedad.
Peso = P = m*g = masa*gravedad
Sustituimos P en la formula de Pe y tenemos que:
Pe = (m*g)/v = d*g = densidad por aceleración de la gravedad
Densidades de algunos elementos
Agua = 1000 kg/m3
Glicerina = 1260
Alcohol etílico = 810
Madera de pino = 420
Platino = 21400
Huesos = 1700 y 2000
VIDEO: https://www.youtube.com/watch?feature=player_embedded&v=4DXRk3j036I
LA PRESIÓN Y SUS TIPOS
LA PRESION Y SUS TIPOS
Presión.
Existen varios tipos de presión. Las podemos clasificar de la siguiente manera:
1. Presión atmosférica.
2. Presión absoluta.
3. Presión relativa.
Pero antes de tratar sobre las diferencias entre estas presiones, vamos a definir qué es la presión en si misma.
La presión es el cociente entre la fuerza normal que incide sobre una superficie o cuerpo y el valor del cuerpo o la superficie. De esta forma obtenemos esta fórmula:
Presión atmosférica.
Torricelli realizó un experimento que consistía en verter mercurio en un tubo de vidrio, colocó el tubo de vidrio en una cubeta rellena de mercurio, dejando la parte abierta del tubo dentro de la cubeta y la parte cerrada en el exterior de la cubeta. Realizando dichas operaciones, observó que el mercurio quedaba a determinada altura dentro del tubo. Pero lo curioso del experimento era que la altura en que quedaba el mercurio dentro del tubo, variaba dependiendo de la altitud y de ciertas condiciones climatológicas. Al hacerlo sobre el nivel del mar, la altura del mercurio alcanzaba los 760 mm. A este valor se le denominó 1 atmósfera.
La presión atmosférica es la presión que ejerce la atmósfera sobre todos los cuerpos de la tierra o que están en el interior de la atmósfera.
Peso específico.
Antes de continuar tratando de las presiones, debemos aclarar que es el peso específico de un líquido y de un gas.
Se denomina peso específico de un gas o líquido al peso de la unidad de su volumen.
Tanto la temperatura como la presión influyen en el peso específico, por este motivo se acostumbra a indicar éstos valores cuando se da el valor del peso específico, normalmente en Kg/m3 o en gr/cm3.
Presión absoluta.
Se denomina presión absoluta a la presión que soporta un sistema respecto al cero absoluto. Para poder decir que existe sobrepresión la presión absoluta debe ser superior a la presión atmosférica.
Sin embargo, cuando la presión absoluta es inferior a la presión atmosférica decimos que existe una depresión.
Para complicar un poco el asunto, diremos que la sobrepresión y la depresión son la presión relativa.
Hay que tener en cuenta, que tanto la presión absoluta (Pab) como la presión relativa (Pr) están en función de la presión atmosférica (P0).
VIDEOS : http://www.youtube.com/watch?v=F2vVrl-jczM&feature=youtu.be
Presión.
Existen varios tipos de presión. Las podemos clasificar de la siguiente manera:
1. Presión atmosférica.
2. Presión absoluta.
3. Presión relativa.
Pero antes de tratar sobre las diferencias entre estas presiones, vamos a definir qué es la presión en si misma.
La presión es el cociente entre la fuerza normal que incide sobre una superficie o cuerpo y el valor del cuerpo o la superficie. De esta forma obtenemos esta fórmula:
Presión atmosférica.
Torricelli realizó un experimento que consistía en verter mercurio en un tubo de vidrio, colocó el tubo de vidrio en una cubeta rellena de mercurio, dejando la parte abierta del tubo dentro de la cubeta y la parte cerrada en el exterior de la cubeta. Realizando dichas operaciones, observó que el mercurio quedaba a determinada altura dentro del tubo. Pero lo curioso del experimento era que la altura en que quedaba el mercurio dentro del tubo, variaba dependiendo de la altitud y de ciertas condiciones climatológicas. Al hacerlo sobre el nivel del mar, la altura del mercurio alcanzaba los 760 mm. A este valor se le denominó 1 atmósfera.
La presión atmosférica es la presión que ejerce la atmósfera sobre todos los cuerpos de la tierra o que están en el interior de la atmósfera.
Peso específico.
Antes de continuar tratando de las presiones, debemos aclarar que es el peso específico de un líquido y de un gas.
Se denomina peso específico de un gas o líquido al peso de la unidad de su volumen.
Tanto la temperatura como la presión influyen en el peso específico, por este motivo se acostumbra a indicar éstos valores cuando se da el valor del peso específico, normalmente en Kg/m3 o en gr/cm3.
Presión absoluta.
Se denomina presión absoluta a la presión que soporta un sistema respecto al cero absoluto. Para poder decir que existe sobrepresión la presión absoluta debe ser superior a la presión atmosférica.
Sin embargo, cuando la presión absoluta es inferior a la presión atmosférica decimos que existe una depresión.
Para complicar un poco el asunto, diremos que la sobrepresión y la depresión son la presión relativa.
Hay que tener en cuenta, que tanto la presión absoluta (Pab) como la presión relativa (Pr) están en función de la presión atmosférica (P0).
VIDEOS : http://www.youtube.com/watch?v=F2vVrl-jczM&feature=youtu.be
PRINCIPIO DE PASCAL
PRINCIPIO DE PASCAL
El principio de Pascal aplica a todos los fluidos: tanto líquidos como gases. Además, resalta una diferencia importante entre los fluidos y los sólidos: un fluido es capaz de transmitir presión (sin que ésta se vea disminuida), mientras que un sólido solamente puede transmitir una fuerza (sin que ésta se vea disminuida). Pero, a pesar de que este principio es válido para gases, un gas no puede ser utilizado para una herramienta que funciona según el principio de Pascal porque éstos son compresibles. Mucho del esfuerzo que se emplearía en operar la herramienta se desperdiciaría en la compresión del gas.
VIDEO : http://www.youtube.com/watch?v=yOtAiqx8j5E&feature=youtu.be
El principio de Pascal aplica a todos los fluidos: tanto líquidos como gases. Además, resalta una diferencia importante entre los fluidos y los sólidos: un fluido es capaz de transmitir presión (sin que ésta se vea disminuida), mientras que un sólido solamente puede transmitir una fuerza (sin que ésta se vea disminuida). Pero, a pesar de que este principio es válido para gases, un gas no puede ser utilizado para una herramienta que funciona según el principio de Pascal porque éstos son compresibles. Mucho del esfuerzo que se emplearía en operar la herramienta se desperdiciaría en la compresión del gas.
VIDEO : http://www.youtube.com/watch?v=yOtAiqx8j5E&feature=youtu.be
PRINCIPIO DE ARQUIMEDES
PRINCIPIO DE ARQUIMIDES
El principio de Arquímedes afirma que todo cuerpo sumergido en un fluido experimenta un empuje vertical y hacia arriba igual al peso de fluido desalojado.
La explicación del principio de Arquímedes consta de dos partes como se indica en la figuras:
1.El estudio de las fuerzas sobre una porción de fluido en equilibrio con el resto del fluido.
2.La sustitución de dicha porción de fluido por un cuerpo sólido de la misma forma y dimensiones.
Porción de fluido en equilibrio con el resto del fluido.
Consideremos, en primer lugar, las fuerzas sobre una porción de fluido en equilibrio con el resto de fluido. La fuerza que ejerce la presión del fluido sobre la superficie de separación es igual a p·dS, dondep solamente depende de la profundidad y dS es un elemento de superficie.
Puesto que la porción de fluido se encuentra en equilibrio, la resultante de las fuerzas debidas a la presión se debe anular con el peso de dicha porción de fluido. A esta resultante la denominamos empuje y su punto de aplicación es el centro de masa de la porción de fluido, denominado centro de empuje.
De este modo, para una porción de fluido en equilibrio con el resto, se cumple
Empuje=peso=rf·gV
VIDEO : http://www.youtube.com/watch?v=gpF2ox1eQ10&feature=youtu.be
El principio de Arquímedes afirma que todo cuerpo sumergido en un fluido experimenta un empuje vertical y hacia arriba igual al peso de fluido desalojado.
La explicación del principio de Arquímedes consta de dos partes como se indica en la figuras:
1.El estudio de las fuerzas sobre una porción de fluido en equilibrio con el resto del fluido.
2.La sustitución de dicha porción de fluido por un cuerpo sólido de la misma forma y dimensiones.
Porción de fluido en equilibrio con el resto del fluido.
Consideremos, en primer lugar, las fuerzas sobre una porción de fluido en equilibrio con el resto de fluido. La fuerza que ejerce la presión del fluido sobre la superficie de separación es igual a p·dS, dondep solamente depende de la profundidad y dS es un elemento de superficie.
Puesto que la porción de fluido se encuentra en equilibrio, la resultante de las fuerzas debidas a la presión se debe anular con el peso de dicha porción de fluido. A esta resultante la denominamos empuje y su punto de aplicación es el centro de masa de la porción de fluido, denominado centro de empuje.
De este modo, para una porción de fluido en equilibrio con el resto, se cumple
Empuje=peso=rf·gV
VIDEO : http://www.youtube.com/watch?v=gpF2ox1eQ10&feature=youtu.be
HIDRODINAMICA
HIDRODINAMICA
La hidrodinámica estudia la dinámica de los líquidos.
Para el estudio de la hidrodinámica normalmente se consideran tres aproximaciones importantes:
Que el fluido es un líquido incompresible, es decir, que su densidad no varía con el cambio de presión, a diferencia de lo que ocurre con los gases.
Se considera despreciable la pérdida de energía por la viscosidad, ya que se supone que un líquido es óptimo para fluir y esta pérdida es mucho menor comparándola con la inercia de su movimiento.
Se supone que el flujo de los líquidos es en régimen estable o estacionario, es decir, que la velocidad del líquido en un punto es independiente del tiempo.
La hidrodinámica tiene numerosas aplicaciones industriales, como diseño de canales, construcción de puertos y presas, fabricación de barcos, turbinas, etc.
Daniel Bernoulli fue uno de los primeros matemáticos que realizó estudios de hidrodinámica.
VIDEO : http://www.youtube.com/watch?v=4fnDlMB4Gpw&feature=youtu.be
La hidrodinámica estudia la dinámica de los líquidos.
Para el estudio de la hidrodinámica normalmente se consideran tres aproximaciones importantes:
Que el fluido es un líquido incompresible, es decir, que su densidad no varía con el cambio de presión, a diferencia de lo que ocurre con los gases.
Se considera despreciable la pérdida de energía por la viscosidad, ya que se supone que un líquido es óptimo para fluir y esta pérdida es mucho menor comparándola con la inercia de su movimiento.
Se supone que el flujo de los líquidos es en régimen estable o estacionario, es decir, que la velocidad del líquido en un punto es independiente del tiempo.
La hidrodinámica tiene numerosas aplicaciones industriales, como diseño de canales, construcción de puertos y presas, fabricación de barcos, turbinas, etc.
Daniel Bernoulli fue uno de los primeros matemáticos que realizó estudios de hidrodinámica.
VIDEO : http://www.youtube.com/watch?v=4fnDlMB4Gpw&feature=youtu.be
GASTOS Y ECUACIÓN DE CONTINUIDAD
el gasto flujo o caudal Q se refiere a la cantidad de agua (en volumen) que sale a cierto tiempo
las dimensionales pueden ser Lt/ min Mt^3/seg Gal/seg y la ecuacion de la continuidad nos habla de que el producto del area y la velocidad de un fluido incomprensible en cualquier punto a lo largo de una tuberia es constante y la EQ es
A1*V1=A2*V2
A= area en mt^2
V= rapidez en mt/seg
VIDEO: http://www.youtube.com/watch?v=BzHeEa8vrXA&feature=youtu.be
las dimensionales pueden ser Lt/ min Mt^3/seg Gal/seg y la ecuacion de la continuidad nos habla de que el producto del area y la velocidad de un fluido incomprensible en cualquier punto a lo largo de una tuberia es constante y la EQ es
A1*V1=A2*V2
A= area en mt^2
V= rapidez en mt/seg
VIDEO: http://www.youtube.com/watch?v=BzHeEa8vrXA&feature=youtu.be
TEOREMA DE BERNOULLI Y SUS APLICACIONES
También es denominado ecuación de Bernoulli o Trinomio de Bernoulli, describe el comportamiento de un fluido moviéndose a lo largo de una línea de corriente.
"Según el cual la presión ejercida por un fluido (aire, agua, etc.) es inversamente proporcional a su velocidad de flujo"
Fue expuesto por Daniel Bernoulli en su obra Hidrodinámica (1738) y expresa que en un fluido ideal (sin viscosidad ni rozamiento) en régimen de circulación por un conducto cerrado, la energía que posee el fluido permanece constante a lo largo de su recorrido. La energía de un fluido en cualquier momento consta de tres componentes:
Cinético: es la energía debida a la velocidad que posea el fluido.
Potencial gravitacional: es la energía debido a la altitud que un fluido posea.
Energía de flujo: es la energía que un fluido contiene debido a la presión que posee.
Se aplica al flujo sobre superficies, como las alas de un avión o las hélices de un barco. Las alas están diseñadas para que obliguen al aire a fluir con mayor velocidad sobre la superficie superior que sobre la inferior, por lo que la presión sobre esta última es mayor que sobre la superior. Esta diferencia de presión proporciona la fuerza de sustentación que mantiene al avión en vuelo y por eso puede volar.
Sustentación de aviones
El efecto Bernoulli es también en parte el origen de la sustentación de los aviones. Gracias a la forma y orientación de los perfiles aerodinámicos, el ala es curva en su cara superior y está angulada respecto a las líneas de corriente incidentes. Por ello, las líneas de corriente arriba del ala están mas juntas que abajo, por lo que la velocidad del aire es mayor y la presión es menor arriba del ala; al ser mayor la presión abajo del ala, se genera una fuerza neta hacia arriba llamada sustentación.
Chimenea
Las chimeneas son altas para aprovechar que la velocidad del viento es más constante y elevada a mayores alturas. Cuanto más rápidamente sopla el viento sobre la boca de una chimenea, más baja es la presión y mayor es la diferencia de presión entre la base y la boca de la chimenea, en consecuencia, los gases de combustión se extraen mejor.
Tubería
La ecuación de Bernoulli y la ecuación de continuidad también nos dicen que si reducimos el área transversal de una tubería para que aumente la velocidad del fluido que pasa por ella, se reducirá la presión.
VIDEO: http://www.youtube.com/watch?v=qHjMTtengnA&feature=youtu.be
"Según el cual la presión ejercida por un fluido (aire, agua, etc.) es inversamente proporcional a su velocidad de flujo"
Fue expuesto por Daniel Bernoulli en su obra Hidrodinámica (1738) y expresa que en un fluido ideal (sin viscosidad ni rozamiento) en régimen de circulación por un conducto cerrado, la energía que posee el fluido permanece constante a lo largo de su recorrido. La energía de un fluido en cualquier momento consta de tres componentes:
Cinético: es la energía debida a la velocidad que posea el fluido.
Potencial gravitacional: es la energía debido a la altitud que un fluido posea.
Energía de flujo: es la energía que un fluido contiene debido a la presión que posee.
Se aplica al flujo sobre superficies, como las alas de un avión o las hélices de un barco. Las alas están diseñadas para que obliguen al aire a fluir con mayor velocidad sobre la superficie superior que sobre la inferior, por lo que la presión sobre esta última es mayor que sobre la superior. Esta diferencia de presión proporciona la fuerza de sustentación que mantiene al avión en vuelo y por eso puede volar.
Sustentación de aviones
El efecto Bernoulli es también en parte el origen de la sustentación de los aviones. Gracias a la forma y orientación de los perfiles aerodinámicos, el ala es curva en su cara superior y está angulada respecto a las líneas de corriente incidentes. Por ello, las líneas de corriente arriba del ala están mas juntas que abajo, por lo que la velocidad del aire es mayor y la presión es menor arriba del ala; al ser mayor la presión abajo del ala, se genera una fuerza neta hacia arriba llamada sustentación.
Chimenea
Las chimeneas son altas para aprovechar que la velocidad del viento es más constante y elevada a mayores alturas. Cuanto más rápidamente sopla el viento sobre la boca de una chimenea, más baja es la presión y mayor es la diferencia de presión entre la base y la boca de la chimenea, en consecuencia, los gases de combustión se extraen mejor.
Tubería
La ecuación de Bernoulli y la ecuación de continuidad también nos dicen que si reducimos el área transversal de una tubería para que aumente la velocidad del fluido que pasa por ella, se reducirá la presión.
VIDEO: http://www.youtube.com/watch?v=qHjMTtengnA&feature=youtu.be
TEMPERATURA
LA TEMPERATURA
¿Qué es?
Todos sabemos intuitivamente de qué estamos hablando. Por medio del tacto notamos la temperatura al tocar un cuerpo ya que unas terminaciones nerviosas situadas en la piel se encargan de ello.
Los gatos poseen termosensores en la nariz que les permiten distinguir variaciones de 0.2ºC.
| Vamos estudiar el comportamiento de un gas para tratar de asociar esta sensación a una magnitud (algo que podemos medir) y para comprender qué cualidades de la materia manifiesta. Toda la materia está formada por partículas en continua agitación:. incluso los sólidos, que a simple vista parecen estar en reposo, la tienen. En los sólidos las vibraciones son pequeñas. Si la energía de agitación es muy grande, se pueden llegar a romper los enlaces entre las moléculas y entre los átomos. Las partículas se desenlazan y vibran libres, rotan, chocan entre si y contra las paredes del recipiente. |
No todas las partículas se mueven en la misma dirección y con la misma velocidad. A cada estado concreto se le puede asignar una velocidad media.
En esta animación puedes ver las moléculas de un gas en continua agitación.
En un gas la temperatura es una magnitud (algo que podemos medir) que se relaciona con la medida de la velocidad media con que se mueven las partículas (por lo tanto con su energía cinética o nivel de agitación).
La temperatura no depende del número de partículas que se mueven sino de su velocidad media: a mayor temperatura mayor velocidad media. No depende por tanto de la masa total del cuerpo: si dividimos un cuerpo con una temperatura "T" en dos partes desiguales las dos tienen la misma temperatura.
La temperatura es una magnitud que refleja el nivel térmico de un cuerpo (su capacidad para ceder energía calorífica) y el calor es la energía que pierde o gana en ciertos procesos (es un flujo de energía entre dos cuerpos que están a diferentes temperaturas).
Nivel térmico es el nivel de agitación. Comparando los niveles térmicos sabemos hacia donde fluye el calor.
La temperatura refleja el nivel térmico de un cuerpo e indica el sentido en que fluye el calor.
La temperatura está relacionada con la presión
¿Cómo se mide la temperatura?
Nuestro tacto detecta la temperatura, pero carece de la capacidad de medirla con rigor.
 | Realizando esta experiencia lo comprenderás: Introduce una mano en un recipiente frío y la otra en uno caliente, y luego las dos manos juntas en otro recipiente con agua templada. La primera mano la encontrará caliente y la otra fría. |
Si un cuerpo recibe energía calorífica aumenta la agitación de las partículas que lo forman (átomos, moléculas o iones) y se pueden producir también cambios en la materia: dilatación, cambios de color (piensa en una barra de metal al calentarla), variación de su resistencia a la conducción, etc. Estos cambios se pueden utilizar para hacer una escala de temperatura.
Al poner en contacto dos sustancias la agitación de las partículas de una se transmite, mediante choques, a las partículas de la otra hasta que se igualan sus velocidades. Las partículas de la sustancia más caliente son más rápidas y poseen más energía. En cada impacto ceden parte de la energía a las partículas más lentas con las que entran en contacto. Las partículas de la sustancia que está a mayor T se frenan un poco, pero al mismo tiempo hacen que la más lentas aceleren.
Finalmente las partículas de las dos sustancias alcanzan la misma velocidad media y por lo tanto la misma temperatura: se alcanza el "equilibrio térmico".
Para diseñar un instrumento que mida la temperatura debemos escoger una cualidad de la materia que sea fácilmente observable, que varíe de manera importante con la agitación de sus partículas, que sea fácil de medir y que nos permita relacionar su variación con la agitación que tiene el cuerpo.
La cualidad elegida en los termómetros de mercurio es la dilatación, pero existen otros tipos de termómetros basados en otras cualidades.
Se utiliza el mercurio para construir termómetros porque es un metal que es líquido entre -20 ºC y 100ºC y porque se dilata mucho. Encerramos el metal dentro de un tubo fino (capilar) para que al dilatarse un poco avance mucho por el tubo (cuanto más fino sea el tubo más centímetros avanza). Midiendo longitudes de la columna podemos establecer una relación entre la dilatación y el nivel de agitación de la sustancia a medir.
VIDEO: http://www.youtube.com/watch?v=m_Uvjs4mLmA&feature=youtu.be
ESCALAS TERMOMÉTRICAS
Termometría
La termometría se encarga de la medición de la temperatura de cuerpos o sistemas. Para este fin, se utiliza el termómetro, que es un instrumento que se basa en el cambio de alguna propiedad de la materia debido al efecto del calor; así se tiene el termómetro de mercurio y de alcohol, que se basan en la dilatación, los termopares que deben su funcionamiento al cambio de la conductividad eléctrica, los ópticos que detectan la variación de la intensidad del rayo emitido cuando se refleja en un cuerpo caliente.
Para poder construir el termómetro se utiliza el Principio Cero de la Termodinámica que dice: "Si un sistema A que está en equilibrio térmico con un sistema B, está en equilibrio térmico también con un sistema C, entonces los tres sistemas A, B y C están en equilibrio térmico entre sí".
MECANISMOS DE TRANSFERENCIA DE CALOR
Transferencia de calor

Una barra al rojo-vivo, transfiere calor al ambiente principalmente por radiación térmica y en menor medida por convección, ya que la transferencia por radiación es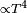 y la convección
y la convección 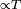 .
.
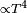 y la convección
y la convección 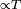 .
.
En física, la transferencia de calor es el paso de energía térmica desde un cuerpo de mayor temperatura a otro de menor temperatura. Cuando un cuerpo, por ejemplo, un objeto sólido o un fluido, está a una temperatura diferente de la de su entorno u otro cuerpo, la transferencia de energía térmica, también conocida como transferencia de calor o intercambio de calor, ocurre de tal manera que el cuerpo y su entorno alcancen equilibrio térmico. La transferencia de calor siempre ocurre desde un cuerpo más caliente a uno más frío, como resultado de la Segunda ley de la termodinámica. Cuando existe una diferencia de temperatura entre dos objetos en proximidad uno del otro, la transferencia de calor no puede ser detenida; solo puede hacerse más lenta.
DILATACIÓN DE LOS CUERPOS
Dilatación de los Cuerpos
 La mayoría de los materiales, en la naturaleza por efecto del calor se dilatan, es decir aumentan su longitud, su área, su volumen. dependiendo del tipo de distribución de masa, en el caso que sea una distribución lineal, hablamos de dilatación lineal, si la distribución de área. la dilatación es superficial, y en el caso general el cambio de volumen, hablamos de dilatación volumétrica. En general el cambio de temperatura ocasiona cambios en los cuerpos.
La mayoría de los materiales, en la naturaleza por efecto del calor se dilatan, es decir aumentan su longitud, su área, su volumen. dependiendo del tipo de distribución de masa, en el caso que sea una distribución lineal, hablamos de dilatación lineal, si la distribución de área. la dilatación es superficial, y en el caso general el cambio de volumen, hablamos de dilatación volumétrica. En general el cambio de temperatura ocasiona cambios en los cuerpos.Aunque existen algunos materiales para los cuales el efecto del calor ocasiona que su volumen disminuye, es decir en vez de dilatarse se contraen, es el caso del agua, un caso especial y gracias al cual es factible la vida en los lagos congelados, esto ocurre entre los cero y cuatro grados Celsius, donde el agua en vez de dilatarse se contrae alcanzando la máxima concentración de masa y por tanto la máxima densidad, en le caso de lagos lleva a efectuar el proceso de convección, lo cual lleva a que la parte interior en los lagos congelados quede a cuatro grados Celsius, y esto permite la vida en estos.
Para medir la dilatación de los materiales se establece la relación entre la temperatura, el volumen y la razón entre estos dos parámetros nos da la medida de la dilatación a través de un coeficiente llamado coeficiente de dilatación térmica, en el caso linea se usa la letra griega "alfa", para el caso superficial se usa "beta" y para el caso volumétrico se usa "gamma".
Coeficiente gamma = (Cambio de Volumen) / (Cambio de Temperatura)*(Volumen Inicial
La dilatación de los cuerpos se consideran por ejemplo en las construcciones de edificios, donde se dejan rendijas, espacios entre paredes para cuando lleguen las épocas de calor estos materiales se puedan expandir y tener espacio para ello. También en la construcción de naves como aviones, etc, etc.
DILATACIÓN SUPERFICIAL
DILATACIÓN SUPERFICIAL
Para algunos tal vez este concepto tal vez suene extraño pero pronto veras que es un fenómeno mas común de lo que parece.
.
 Alguna vez te has notado que los rieles de un tren están un poco separados.Esto es por que con la calor del sol hace que se expandan y crezcan un poco.No me crees? Verdad que parece ilógico que crezcan?Pues en realidad es lo que sucede.
Alguna vez te has notado que los rieles de un tren están un poco separados.Esto es por que con la calor del sol hace que se expandan y crezcan un poco.No me crees? Verdad que parece ilógico que crezcan?Pues en realidad es lo que sucede.Nosotros estudiaremos este fenómeno, enfocado hacia superficies como puede ser los rieles de un ferrocarril o una una lamina de aluminio.
Ahora pongamonos un poco mas científicos y el concepto de dilatación superficial.
Empecemos desde el principio. Que es dilatación?
Cuando un cuerpo recibe calor, sus partículas se mueven más deprisa, por lo que necesitan más espacio para desplazarse y, por tanto, el volumen del cuerpo aumenta. A este aumento de volumen se le llama dilatación
Entonces, la dilatación superficial es el expansión de una superficie que experimenta un cuerpo al ser calentado.
El fenómeno de dilatación superficial se presenta, por lo general en placas metálicas o en láminas muy delgadas, donde podemos apreciar su espesor.
En estas placas metálicas, al aplicarles calor se produce una expansión de su superficie o área ,es decir, crecen un poco.
Para calcular la variación de superficie que experimenta una placa metálica, por ejemplo, se aplica la expresión :
............... Af = Ao ( 1 + β . Δt )
donde ;
Af = Area o Superficie final
Ao = Area o Superficie inicial
β = Coeficiente de dilatación Superficial
Δt = variación de temperatura ( Tf -- To)
VIDEO : http://www.youtube.com/watch?v=jJU3xmdnnlU&feature=youtu.be
CALOR ESPECIFICO
Calor específico
El calor específico es una magnitud física que se define como la cantidad de calor que hay que suministrar a la unidad de masa de una sustancia o sistema termodinámico para elevar su temperatura en una unidad (kelvin o grado Celsius). En general, el valor del calor específico depende de dicha temperatura inicial.1 2 Se le representa con la letra  (minúscula).
(minúscula).
 (minúscula).
(minúscula).
De forma análoga, se define la capacidad calorífica como la cantidad de calor que hay que suministrar a toda la masa de una sustancia para elevar su temperatura en una unidad (kelvin o grado Celsius). Se la representa con la letra 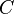 (mayúscula).Por lo tanto, el calor específico es el cociente entre la capacidad calorífica y la masa, esto es
(mayúscula).Por lo tanto, el calor específico es el cociente entre la capacidad calorífica y la masa, esto es 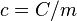 donde
donde 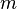 es la masa de la sustancia.1
es la masa de la sustancia.1
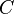 (mayúscula).Por lo tanto, el calor específico es el cociente entre la capacidad calorífica y la masa, esto es
(mayúscula).Por lo tanto, el calor específico es el cociente entre la capacidad calorífica y la masa, esto es 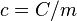 donde
donde 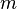 es la masa de la sustancia.1
es la masa de la sustancia.1VIDEO: http://www.youtube.com/watch?v=h4UXcsQkR-g&feature=youtu.be
jueves, 14 de marzo de 2013
4TO SEMESTRE 1ER PARCIAL
PLASMAS
Los plasmas son gases calientes e ionizados. Los plasmas se forman bajo condiciones de extremadamente alta energía, tan alta, en realidad, que las moléculas se separan violentamente y sólo existen átomos sueltos. Más sorprendente aún, los plasmas tienen tanta energía que los electrones exteriores son violentamente separados de los átomos individuales, formando así un gas de iones altamente cargados y energéticos. Debido a que los átomos en los plasma existen como iones cargados, los plasmas se comportan de manera diferente que los gases y forman el cuarto estado de la materia. Los plasmas pueden ser percibidos simplemente al mirar para arriba; las condiciones de alta energía que existen en las estrellas, tales como el sol, empujan a los átomos individuales al estado de plasma.
Como hemos visto, el aumento de energía lleva a mayor movimiento molecular. A la inversa, la energía que disminuye lleva a menor movimiento molecular. Como resultado, una predicción de la Teoría Kinética Molecular es que si se disminuye la energía (medida como temperatura) de una sustancia, llegaremos a un punto en que todo el movimiento molecular se detiene. La temperatura en la cual el movimiento molecular se detiene se llama cero absoluto y se calcula que es de -273.15 grados Celsius. Aunque los científicos han enfríado sustancias hasta llegar cerca del cero absoluto, nunca han podido llegar a esta temperatura. La dificultad en observar una sustancia a una temperatura de cero absoluto es que para poder “ver” la sustancia se necesita luz y la luz transfiere energía a la sustancia, lo cual eleva la temperatura. A pesar de estos desafíos, los científicos han observado, recientemente, un quinto estado de la materia que sólo existe a temperaturas muy cercanas al cero absoluto.
Los Condensados Bose-Einstein representan un quinto estado de la materia visto por primera vez en 1955. El estado lleva el nombre de Satyendra Nath Bose y Albert Einstein, quien predijo su existencia hacia 1920. Los condensados B-E son superfluídos gaseosos enfríados a temperaturas muy cercanas al cero absoluto. En este extraño estado, todos los átomos de los condensados alcanzan el mismo estado mecánico-quantum y pueden fluir sin tener ninguna fricción entre sí. Aún más extraño es que los condensados B-E pueden “atrapar” luz, para después soltarla cuando el estado se rompe.
También han sido descritos o vistos varios otros estados de la materia menos comunes. Algunos de estos estados incluyen cristales líquidos, condensados fermiónicos, superfluídos, supersólidos y el correctamente denominado "extraña materia". Para leer más sobre estas fases, visite la página Phase (Fase) de la Wikipedia, cuyo enlace se encuentra en la sección Para Seguir Explorando.
Transiciones de Fase
La transformación de un estado de la materia a otro se denomina transición de fase. Las transiciones de fase más comunes tienen hasta nombre. Por ejemplo, los términos derretir y congelar describen transiciones de fase entre un estado sólido y líquido y los términos evaporación y condensación describen transiciones entre el estado líquido y gaseoso. Las transiciones de fase ocurren en momentos muy precisos, cuando la energía (medida en temperatura) de una sustancia de un estado, excede la energía permitida en ese estado. Por ejemplo, el agua líquida puede existir a diferentes niveles de temperatura. El agua fría para beber puede estar alrededor de 4ºC. El agua caliente para la ducha tiene más energía y, por lo tanto, puede estar alrededor de 40ºC. Sin embargo, a 100ºC en condiciones normales, el agua empezará una transición de fase y pasará a un estado gaseoso. Por consiguiente, no importa cuán alta es la llama de la cocina, el agua hirviendo en una cacerola se mantendrá a 100ºC hasta que toda el agua haya experimentado la transición al estado gaseoso. El exceso de energía introducido por la alta llama acelerará la transición de líquido al gas; pero no cambiará la temperatura. La curva de calor siguiente ilustra los cambios correspondientes en energía (mostrada en calorías) y la temperatura del agua, a medida que experimenta la transición de fase del estado líquido al estado gaseoso.
Como puede verse en el gráfico superior, el movimiento de izquierda a derecha muestra que la temperatura del agua líquida aumenta a medida que se introduce la energía (calor). A 100ºC el agua empieza a experimentar una transición de fase y la temperatura se mantiene constante, aún cuando se añade energía (la parte plana del gráfico). La energía que se introduce durante este periodo es la responsable de la separación de la fuerzasintermoleculares para que las moléculas de agua individuales puedan “escapar” hacia el estado gaseoso. Finalmente, una vez que la transición ha terminado, si se añade más energía al sistema, aumentará el calor del agua gaseosa o vapor.
Este mismo proceso puede ser visto inversamente, si simplemente miramos al gráfico superior yendo de la derecha hacia la izquierda. A medida que el vapor se enfría, el movimiento de las moléculas del agua gaseosa y, por consiguiente, de la temperatura, disminuirá. Cuando el gas alcanza 100ºC se perderá más energía del sistema a medida que las fuerzas de atracción entre las moléculas se reformen. Sin embargo, la temperatura se mantiene constante durante la transición (la parte plana del gráfico). Finalmente, cuando la condensación se acaba, la temperatura del líquido empezará a disminuir a medida que la energía se retira.
Las transiciones de fase son una parte importante del mundo que nos rodea. Por ejemplo, la energía que se pierde cuando la perspiración se evapora de la superficie de nuestra piel, le permite a nuestro cuerpo regular correctamente su temperatura durante los día cálidos. Las transiciones de fase tienen un importante rol en la geología, influenciando la formaciónmineral y, posiblemente, hasta los terremotos. Y quién puede ignorar la transición de fase que ocurre a aproximadamente -3ºC, cuando la crema, tal vez con algunas fresas o pedazos de chocolate, empieza a formar un sólido helado.
Como puede verse en el gráfico superior, el movimiento de izquierda a derecha muestra que la temperatura del agua líquida aumenta a medida que se introduce la energía (calor). A 100ºC el agua empieza a experimentar una transición de fase y la temperatura se mantiene constante, aún cuando se añade energía (la parte plana del gráfico). La energía que se introduce durante este periodo es la responsable de la separación de la fuerzasintermoleculares para que las moléculas de agua individuales puedan “escapar” hacia el estado gaseoso. Finalmente, una vez que la transición ha terminado, si se añade más energía al sistema, aumentará el calor del agua gaseosa o vapor.
Este mismo proceso puede ser visto inversamente, si simplemente miramos al gráfico superior yendo de la derecha hacia la izquierda. A medida que el vapor se enfría, el movimiento de las moléculas del agua gaseosa y, por consiguiente, de la temperatura, disminuirá. Cuando el gas alcanza 100ºC se perderá más energía del sistema a medida que las fuerzas de atracción entre las moléculas se reformen. Sin embargo, la temperatura se mantiene constante durante la transición (la parte plana del gráfico). Finalmente, cuando la condensación se acaba, la temperatura del líquido empezará a disminuir a medida que la energía se retira.
Las transiciones de fase son una parte importante del mundo que nos rodea. Por ejemplo, la energía que se pierde cuando la perspiración se evapora de la superficie de nuestra piel, le permite a nuestro cuerpo regular correctamente su temperatura durante los día cálidos. Las transiciones de fase tienen un importante rol en la geología, influenciando la formaciónmineral y, posiblemente, hasta los terremotos. Y quién puede ignorar la transición de fase que ocurre a aproximadamente -3ºC, cuando la crema, tal vez con algunas fresas o pedazos de chocolate, empieza a formar un sólido helado.
Video:
http://www.youtube.com/watch?v=DMBfebQI3Us&feature=player_embedded
Los plasmas son gases calientes e ionizados. Los plasmas se forman bajo condiciones de extremadamente alta energía, tan alta, en realidad, que las moléculas se separan violentamente y sólo existen átomos sueltos. Más sorprendente aún, los plasmas tienen tanta energía que los electrones exteriores son violentamente separados de los átomos individuales, formando así un gas de iones altamente cargados y energéticos. Debido a que los átomos en los plasma existen como iones cargados, los plasmas se comportan de manera diferente que los gases y forman el cuarto estado de la materia. Los plasmas pueden ser percibidos simplemente al mirar para arriba; las condiciones de alta energía que existen en las estrellas, tales como el sol, empujan a los átomos individuales al estado de plasma.
Como hemos visto, el aumento de energía lleva a mayor movimiento molecular. A la inversa, la energía que disminuye lleva a menor movimiento molecular. Como resultado, una predicción de la Teoría Kinética Molecular es que si se disminuye la energía (medida como temperatura) de una sustancia, llegaremos a un punto en que todo el movimiento molecular se detiene. La temperatura en la cual el movimiento molecular se detiene se llama cero absoluto y se calcula que es de -273.15 grados Celsius. Aunque los científicos han enfríado sustancias hasta llegar cerca del cero absoluto, nunca han podido llegar a esta temperatura. La dificultad en observar una sustancia a una temperatura de cero absoluto es que para poder “ver” la sustancia se necesita luz y la luz transfiere energía a la sustancia, lo cual eleva la temperatura. A pesar de estos desafíos, los científicos han observado, recientemente, un quinto estado de la materia que sólo existe a temperaturas muy cercanas al cero absoluto.
Los Condensados Bose-Einstein representan un quinto estado de la materia visto por primera vez en 1955. El estado lleva el nombre de Satyendra Nath Bose y Albert Einstein, quien predijo su existencia hacia 1920. Los condensados B-E son superfluídos gaseosos enfríados a temperaturas muy cercanas al cero absoluto. En este extraño estado, todos los átomos de los condensados alcanzan el mismo estado mecánico-quantum y pueden fluir sin tener ninguna fricción entre sí. Aún más extraño es que los condensados B-E pueden “atrapar” luz, para después soltarla cuando el estado se rompe.
También han sido descritos o vistos varios otros estados de la materia menos comunes. Algunos de estos estados incluyen cristales líquidos, condensados fermiónicos, superfluídos, supersólidos y el correctamente denominado "extraña materia". Para leer más sobre estas fases, visite la página Phase (Fase) de la Wikipedia, cuyo enlace se encuentra en la sección Para Seguir Explorando.
Transiciones de Fase
La transformación de un estado de la materia a otro se denomina transición de fase. Las transiciones de fase más comunes tienen hasta nombre. Por ejemplo, los términos derretir y congelar describen transiciones de fase entre un estado sólido y líquido y los términos evaporación y condensación describen transiciones entre el estado líquido y gaseoso. Las transiciones de fase ocurren en momentos muy precisos, cuando la energía (medida en temperatura) de una sustancia de un estado, excede la energía permitida en ese estado. Por ejemplo, el agua líquida puede existir a diferentes niveles de temperatura. El agua fría para beber puede estar alrededor de 4ºC. El agua caliente para la ducha tiene más energía y, por lo tanto, puede estar alrededor de 40ºC. Sin embargo, a 100ºC en condiciones normales, el agua empezará una transición de fase y pasará a un estado gaseoso. Por consiguiente, no importa cuán alta es la llama de la cocina, el agua hirviendo en una cacerola se mantendrá a 100ºC hasta que toda el agua haya experimentado la transición al estado gaseoso. El exceso de energía introducido por la alta llama acelerará la transición de líquido al gas; pero no cambiará la temperatura. La curva de calor siguiente ilustra los cambios correspondientes en energía (mostrada en calorías) y la temperatura del agua, a medida que experimenta la transición de fase del estado líquido al estado gaseoso.
Como puede verse en el gráfico superior, el movimiento de izquierda a derecha muestra que la temperatura del agua líquida aumenta a medida que se introduce la energía (calor). A 100ºC el agua empieza a experimentar una transición de fase y la temperatura se mantiene constante, aún cuando se añade energía (la parte plana del gráfico). La energía que se introduce durante este periodo es la responsable de la separación de la fuerzasintermoleculares para que las moléculas de agua individuales puedan “escapar” hacia el estado gaseoso. Finalmente, una vez que la transición ha terminado, si se añade más energía al sistema, aumentará el calor del agua gaseosa o vapor.
Este mismo proceso puede ser visto inversamente, si simplemente miramos al gráfico superior yendo de la derecha hacia la izquierda. A medida que el vapor se enfría, el movimiento de las moléculas del agua gaseosa y, por consiguiente, de la temperatura, disminuirá. Cuando el gas alcanza 100ºC se perderá más energía del sistema a medida que las fuerzas de atracción entre las moléculas se reformen. Sin embargo, la temperatura se mantiene constante durante la transición (la parte plana del gráfico). Finalmente, cuando la condensación se acaba, la temperatura del líquido empezará a disminuir a medida que la energía se retira.
Las transiciones de fase son una parte importante del mundo que nos rodea. Por ejemplo, la energía que se pierde cuando la perspiración se evapora de la superficie de nuestra piel, le permite a nuestro cuerpo regular correctamente su temperatura durante los día cálidos. Las transiciones de fase tienen un importante rol en la geología, influenciando la formaciónmineral y, posiblemente, hasta los terremotos. Y quién puede ignorar la transición de fase que ocurre a aproximadamente -3ºC, cuando la crema, tal vez con algunas fresas o pedazos de chocolate, empieza a formar un sólido helado.
Como puede verse en el gráfico superior, el movimiento de izquierda a derecha muestra que la temperatura del agua líquida aumenta a medida que se introduce la energía (calor). A 100ºC el agua empieza a experimentar una transición de fase y la temperatura se mantiene constante, aún cuando se añade energía (la parte plana del gráfico). La energía que se introduce durante este periodo es la responsable de la separación de la fuerzasintermoleculares para que las moléculas de agua individuales puedan “escapar” hacia el estado gaseoso. Finalmente, una vez que la transición ha terminado, si se añade más energía al sistema, aumentará el calor del agua gaseosa o vapor.
Este mismo proceso puede ser visto inversamente, si simplemente miramos al gráfico superior yendo de la derecha hacia la izquierda. A medida que el vapor se enfría, el movimiento de las moléculas del agua gaseosa y, por consiguiente, de la temperatura, disminuirá. Cuando el gas alcanza 100ºC se perderá más energía del sistema a medida que las fuerzas de atracción entre las moléculas se reformen. Sin embargo, la temperatura se mantiene constante durante la transición (la parte plana del gráfico). Finalmente, cuando la condensación se acaba, la temperatura del líquido empezará a disminuir a medida que la energía se retira.
Las transiciones de fase son una parte importante del mundo que nos rodea. Por ejemplo, la energía que se pierde cuando la perspiración se evapora de la superficie de nuestra piel, le permite a nuestro cuerpo regular correctamente su temperatura durante los día cálidos. Las transiciones de fase tienen un importante rol en la geología, influenciando la formaciónmineral y, posiblemente, hasta los terremotos. Y quién puede ignorar la transición de fase que ocurre a aproximadamente -3ºC, cuando la crema, tal vez con algunas fresas o pedazos de chocolate, empieza a formar un sólido helado.
Video:
http://www.youtube.com/watch?v=DMBfebQI3Us&feature=player_embedded
Generalidades sobre los estados de la materia
La materia
1 Formas y propiedades de la materia
2 Estados de la materia
3. Mezclas y combinanciones
4. La materia experimenta cambios fisicos y quimicos
1. Estados de agregación. El problema de la discontinuidad o continuidad de la materia ha sido discutido hasta una época relativamente cercana. Fueron los trabajos de Lavoisier (1783) y Proust (1815) los que pusieron en evidencia que la materia tiene una estructura discontinua, idea que ya había sido preconizada por Demócrito de Abdera, filósofo griego del s. v a. C.
Las porciones más pequeñas, con cuyo conjunto puede formarse un cuerpo, se llaman moléculas (v.), las que, a su vez, están constituidas por partículas que reciben el nombre de átomos (v.), palabra que en griego quiere decir indivisible. Los griegos atribuían a los átomos una forma, un peso, un color y otras cualidades. Es la Física de las cualidades que impera hasta el s. xvii. Descartes y Leibniz atribuyen a los átomos solamente propiedades geométricas y mecánicas, y conciben a la energía como formando parte del átomo. Piensan que la materia está siempre ligada a la energía: «no se puede concebir la materia separada de la energía».
El número de moléculas que existen (distintas en cuanto a composición o en cuanto a estructura) es extraordinariamente elevado, casi podría decirse que infinito. El número de átomos distintos, por el contrario, es muy reducido: sólo 104, los correspondientes a los 104 elementos químicos (v.) conocidos, los cuales, parece ser, son los únicos que integran la totalidad de la materia que existe en el Universo. Entre las moléculas que forman un determinado material existen fuerzas que, incluso para un mismo compuesto, el agua, p. ej., toman diferentes valores según las condiciones exteriores a que se encuentra sometido. Por ello las moléculas se comportan de manera diferente, pudiendo presentarse los cuerpos en tres estados de agregación.
En los cuerpos sólidos, las moléculas están rígidamente unidas unas con otras, por lo que hay dificultad para romperlos o deformarlos. Los átomos que integran aquellas moléculas se limitan a realizar pequeñas vibraciones alrededor de su posición de equilibrio; es la llamada agitación térmica. Su nombre proviene de que la violencia de las vibraciones aumenta con la temperatura. Las moléculas que integran los cuerpos líquidos, tienen mayor libertad de movimiento y pueden, con facilidad, resbalar las unas sobre las otras. Sin embargo, cuando se comprime un líquido, se ve que hacen falta fuerzas muy intensas para conseguir disminuciones prácticamente insignificantes de volumen. La explicación es que las fuerzas intermoleculares (v) se hacen repulsivas cuando las distancias entre las moléculas son muy pequeñas. Las moléculas que forman los cuerpos gaseosos tienen una gran libertad de movimiento, debido a que las fuerzas intermoleculares son prácticamente nulas. Solamente en el caso fortuito de un choque entre moléculas hay que tenerlas en consideración. Las moléculas se mueven con grandes velocidades y en todas direcciones dentro del recinto que contiene un gas. El desorden en que se mueven origina lo que se llama el caos molecular.
Actualmente se considera un cuarto e. de agregación, que recibe el nombre de plasma (v.). Los átomos, en esencia, se pueden considerar constituidos por un núcleo (v.) central pesado, cargado positivamente, y una envoltura exterior, formada por electrones (v.), cargada negativamente. El conjunto es eléctricamente neutro. Pues bien, el llamado plasma está formado por átomos que han perdido totalmente su carga negativa. Sus propiedades son tan importantes que su estudio constituye lo que ha dado en llamarse Física del plasma.
http://www.youtube.com/watch?feature=player_embedded&v=U6OwBwcL9A8
Estados de la materia
Los sólidos: Tienen forma y volumen constantes. Se caracterizan por la rigidez y regularidad de sus estructuras.
Los líquidos: No tienen forma fija pero sí volumen. La variabilidad de forma y el presentar unas propiedades muy específicas son características de los líquidos.
Los gases: No tienen forma ni volumen fijos. En ellos es muy característica la gran variación de volumen que experimentan al cambiar las condiciones de temperatura y presión
Los diferentes estados de la materia han confundido a la gente durante mucho tiempo. Los antiguos griegos fueron los primeros en identificar tres clases (lo que hoy llamamos estados) de materia, basados en sus observaciones del agua. Pero estos mismos griegos, en particular el filósofo Thales (624 - 545 BC), sugirió, incorrectametne, que puesto que el agua podía existir como un elemento sólido, líquido, o hasta gaseoso bajo condiciones naturales, debía ser el único y principal elemento en el universode donde surgía el resto de sustancias. Hoy sabemos que el agua no es la sustancia fundamental del universo, en realidad, no es ni siquiera un elemento.
Para entender los diferentes estados en los que la materia existe, es necesario entender algo llamado Teoría Molecular Kinética de la Materia. LaTeoría Molecular Kinética tiene muchas partes, pero aquí introduciremos sólo algunas. Uno de los conceptos básicos de la teoría argumenta que los átomos y moléculas poseen una energía de movimiento, que percibimos como temperatura. En otras palabras, los átomos y moléculas están en movimiento constante y medimos la energía de estos movimientos como la temperatura de una sustancia. Mientras más energía hay en una sustancia, mayor movimiento molecular y mayor la temperatrua percibida. Consecuentemente, un punto importante es que la cantidad de energía que tienen los átomos y las moléculas (y por consiguiente la cantidad de movimiento) influye en su interacción. Al contrario que simples bolas de billar, muchos átomos y moléculas se atraen entre sí como resultado de varias fuerzas intermoleculares, como lazos de hidrógenos, fuerzas van der Waals y otras. Los átomos y moléculas que tienen relativamente pequeñas cantidades de energía (y movimiento) interactuarán fuertemente entre sí, mientras que aquellos con relativamente altas cantidades de energía interactuarán poco, si acaso.
¿Cómo se producen estos diferentes estados de la materia? Los átomos que tienen poca energía interactúan mucho y tienden a “encerrarse” y no interactuar con otros átomos. Por consiguiente, colectivamente, estos átomos forman una sustancia dura, lo que llamamos un sólido. Los átomos que poseen mucha energía se mueven libremente, volando en un espacio y forman lo que llamamos gas. Resulta que hay varias formas conocidas de materia, algunas de ellas están detalladas a continuación.
©Corel Corporation
Los sólidos se forman cuando las fuerzas de atracción entre moléculas individuales son mayores que la energía que causa que se separen. Las moléculas individuales se encierran en su posición y se quedan en su lugar sin poder moverse. Aunque los átomos y moléculas de los sólidos se mantienen en movimiento, el movimiento se limita a una energía vibracional y las moléculas individuales se matienen fijas en su lugar y vibran unas al lado de otras. A medida que la temperatura de un sólido aumenta, la cantidad de vibración aumenta, pero el sólido mantiene su forma y volumen ya que las moléculas están encerradas en su lugar y no interactúan entre sí. Para ver un ejemplo de esto, pulsar en la siguiente animación que muestra la estructura molecular de los cristales de hieloLos líquidos se forman cuando la energía (usualmente en forma de calor) de un sistemaaumenta y la estructura rígida del estado sólido se rompe. Aunque en los líquidos las moléculas pueden moverse y chocar entre sí, se mantienen relativamente cerca, como los sólidos. Usualmente, en los líquidos las fuerzas intermoleculares (tales como los lazos de hidrógeno que se muestran en la siguiente animación) unen las moléculas que seguidamente se rompen. A medida que la temperatura de un líquido aumenta, la cantidad de movimiento de las moléculas individuales también aumenta. Como resultado, los líquidos pueden “circular” para tomar la forma de su contenedor pero no pueden ser fácilmente comprimidas porque las moléculas ya están muy unidas. Por consiguiente, los líquidos tienen una forma indefinida, pero un volumen definido. En el ejemplo de animación siguiente, vemos que el agua líquida está formada de moléculas que pueden circular libremente, pero que sin embargo, se mantienen cerca una de otra.
Los gases se forman cuando la energía de unsistema excede todas las fuerzas de atracción entre moléculas. Así, las moléculas de gas interactúan poco, ocasionalmente chocándose. En el estado gaseoso, las moléculas se mueven rápidamente y son libres de circular en cualquier dirección, extendiéndose en largas distancias. A medida que la temperatura aumenta, la cantidad de movimiento de las moléculas individuales aumenta. Los gases se expanden para llenar sus contenedores y tienen una densidad baja. Debido a que las moléculas individuales están ampliamente separadas y pueden circular libremente en el estado gaseoso, los gases pueden ser fácilmente comprimidos y pueden tener una forma indefinida.
Los sólidos, líquidos y gases son los estados más comunes de la materia que existen en nuestro planeta. Si quiere comparar los tres estados, pulse en la siguiente comparación animada . Note las diferencias del movimiento molecular de las moléculas de agua en estos tres estados.
http://www.youtube.com/watch?feature=player_embedded&v=Qb75G--wTNc
Los líquidos: No tienen forma fija pero sí volumen. La variabilidad de forma y el presentar unas propiedades muy específicas son características de los líquidos.
Los gases: No tienen forma ni volumen fijos. En ellos es muy característica la gran variación de volumen que experimentan al cambiar las condiciones de temperatura y presión
Los diferentes estados de la materia han confundido a la gente durante mucho tiempo. Los antiguos griegos fueron los primeros en identificar tres clases (lo que hoy llamamos estados) de materia, basados en sus observaciones del agua. Pero estos mismos griegos, en particular el filósofo Thales (624 - 545 BC), sugirió, incorrectametne, que puesto que el agua podía existir como un elemento sólido, líquido, o hasta gaseoso bajo condiciones naturales, debía ser el único y principal elemento en el universode donde surgía el resto de sustancias. Hoy sabemos que el agua no es la sustancia fundamental del universo, en realidad, no es ni siquiera un elemento.
Para entender los diferentes estados en los que la materia existe, es necesario entender algo llamado Teoría Molecular Kinética de la Materia. LaTeoría Molecular Kinética tiene muchas partes, pero aquí introduciremos sólo algunas. Uno de los conceptos básicos de la teoría argumenta que los átomos y moléculas poseen una energía de movimiento, que percibimos como temperatura. En otras palabras, los átomos y moléculas están en movimiento constante y medimos la energía de estos movimientos como la temperatura de una sustancia. Mientras más energía hay en una sustancia, mayor movimiento molecular y mayor la temperatrua percibida. Consecuentemente, un punto importante es que la cantidad de energía que tienen los átomos y las moléculas (y por consiguiente la cantidad de movimiento) influye en su interacción. Al contrario que simples bolas de billar, muchos átomos y moléculas se atraen entre sí como resultado de varias fuerzas intermoleculares, como lazos de hidrógenos, fuerzas van der Waals y otras. Los átomos y moléculas que tienen relativamente pequeñas cantidades de energía (y movimiento) interactuarán fuertemente entre sí, mientras que aquellos con relativamente altas cantidades de energía interactuarán poco, si acaso.
¿Cómo se producen estos diferentes estados de la materia? Los átomos que tienen poca energía interactúan mucho y tienden a “encerrarse” y no interactuar con otros átomos. Por consiguiente, colectivamente, estos átomos forman una sustancia dura, lo que llamamos un sólido. Los átomos que poseen mucha energía se mueven libremente, volando en un espacio y forman lo que llamamos gas. Resulta que hay varias formas conocidas de materia, algunas de ellas están detalladas a continuación.
©Corel Corporation
Los sólidos se forman cuando las fuerzas de atracción entre moléculas individuales son mayores que la energía que causa que se separen. Las moléculas individuales se encierran en su posición y se quedan en su lugar sin poder moverse. Aunque los átomos y moléculas de los sólidos se mantienen en movimiento, el movimiento se limita a una energía vibracional y las moléculas individuales se matienen fijas en su lugar y vibran unas al lado de otras. A medida que la temperatura de un sólido aumenta, la cantidad de vibración aumenta, pero el sólido mantiene su forma y volumen ya que las moléculas están encerradas en su lugar y no interactúan entre sí. Para ver un ejemplo de esto, pulsar en la siguiente animación que muestra la estructura molecular de los cristales de hieloLos líquidos se forman cuando la energía (usualmente en forma de calor) de un sistemaaumenta y la estructura rígida del estado sólido se rompe. Aunque en los líquidos las moléculas pueden moverse y chocar entre sí, se mantienen relativamente cerca, como los sólidos. Usualmente, en los líquidos las fuerzas intermoleculares (tales como los lazos de hidrógeno que se muestran en la siguiente animación) unen las moléculas que seguidamente se rompen. A medida que la temperatura de un líquido aumenta, la cantidad de movimiento de las moléculas individuales también aumenta. Como resultado, los líquidos pueden “circular” para tomar la forma de su contenedor pero no pueden ser fácilmente comprimidas porque las moléculas ya están muy unidas. Por consiguiente, los líquidos tienen una forma indefinida, pero un volumen definido. En el ejemplo de animación siguiente, vemos que el agua líquida está formada de moléculas que pueden circular libremente, pero que sin embargo, se mantienen cerca una de otra.
Los gases se forman cuando la energía de unsistema excede todas las fuerzas de atracción entre moléculas. Así, las moléculas de gas interactúan poco, ocasionalmente chocándose. En el estado gaseoso, las moléculas se mueven rápidamente y son libres de circular en cualquier dirección, extendiéndose en largas distancias. A medida que la temperatura aumenta, la cantidad de movimiento de las moléculas individuales aumenta. Los gases se expanden para llenar sus contenedores y tienen una densidad baja. Debido a que las moléculas individuales están ampliamente separadas y pueden circular libremente en el estado gaseoso, los gases pueden ser fácilmente comprimidos y pueden tener una forma indefinida.
Los sólidos, líquidos y gases son los estados más comunes de la materia que existen en nuestro planeta. Si quiere comparar los tres estados, pulse en la siguiente comparación animada . Note las diferencias del movimiento molecular de las moléculas de agua en estos tres estados.
http://www.youtube.com/watch?feature=player_embedded&v=Qb75G--wTNc
Suscribirse a:
Entradas (Atom)